Wykonane w laboratorium? Genealogia SARS-CoV-2 poprzez badanie funkcji wzmocnienia funkcji
Jurij Deigin
medium.com
Jeśli usłyszysz, że ktoś twierdzi, że „wiemy, że wirus nie pochodził z laboratorium”, nie kupuj go - może tak być. Laboratoria na całym świecie od lat tworzą syntetyczne wirusy, takie jak CoV2. I nie, jego genom niekoniecznie zawiera znamiona ludzkiej manipulacji: nowoczesne narzędzia inżynierii genetycznej pozwalają wycinać i wklejać fragmenty genomu bez pozostawiania śladu. Można to również zrobić szybko: szwajcarski zespół potrzebował niespełna miesiąca, aby stworzyć syntetyczny klon CoV2.
Jak nauczyłem się martwić
Och przestań. Wykonane w laboratorium? Nonsens! W styczniu taka była moja reakcja, gdy pojawiły się pomysły, że Covid-19 jest spowodowany wyciekami z laboratorium. Broń biologiczna? Cóż, to tylko terytorium szaleństwa Płaskiej Ziemi. Tak więc, ilekroć słyszałem cokolwiek o nienaturalnym pochodzeniu SARS-CoV-2, odsuwałem go na bok w podobnych nastrojach. A co, jeśli w Wuhan istnieje instytut wirusologii? Kto wie, ile z nich jest posypanych w całych Chinach.
W pewnym momencie konieczne stało się odsunięcie na bok takich teorii w uzasadniony sposób, gdy ich zwolennicy zaczęli popierać tezy o możliwej sztucznej naturze wirusa argumentami z biologii molekularnej, a angażując je w debatę, chciałem niszczy ich teorie spiskowe zimnymi, twardymi faktami naukowymi. Tak jak ten papier Nature (a przynajmniej tak myślałem).
Tak więc wtedy, w pogoni za argumentami przeciwko laboratoryjnej złośliwości wirusa, zaraziłem się wirusem wątpliwości. Jakie było źródło moich wątpliwości? Fakt, że im głębiej zagłębiasz się w działalność badawczą koronawirologów w ciągu ostatnich 15–20 lat, tym bardziej zdajesz sobie sprawę, że tworzenie chimer takich jak CoV2 było powszechne w ich laboratoriach. CoV2 jest oczywistą chimerą (choć nie koniecznie produkowaną laboratoryjnie), która opiera się na rodowym szczepie nietoperzy RaTG13, w którym motyw wiążący receptor (RBM) w jego białku kolca jest zastępowany przez RBM ze szczepu łuskowca, a ponadto wstawiono niewielki, ale bardzo specjalny odcinek 4 aminokwasów, który tworzy miejsce cięcia furiny, które, jak ustalili wcześniej wirusolodzy, znacznie rozszerza „repertuar” wirusa pod względem komórek, do których może on przeniknąć. Najprawdopodobniej dzięki temu nowemu miejscu furin nowemu mutantowi udało się przeskoczyć gatunki z pierwotnego gospodarza na ludzi.
Rzeczywiście wirusolodzy, w tym lider badań nad koronawirusami w Wuhan Institute of Virology, Shi Zhengli, zrobili wiele podobnych rzeczy w przeszłości - zarówno zastępując RBM w jednym typie wirusa RBM z innego, lub dodając nowe miejsce furinowe który może zapewnić specyficzny dla gatunku koronawirus z możliwością rozpoczęcia stosowania tego samego receptora (np. ACE2) u innych gatunków. W rzeczywistości grupa Shi Zhengli tworzyła konstrukty chimeryczne już w 2007 r. I jeszcze w 2017 r., Kiedy stworzyli całe 8 nowych koronawirusów chimerycznych z różnymi RBM. W 2019 r. Takie prace były w pełnym rozkwicie, ponieważ WIV był częścią grantu NIH o wartości 3,7 mln USD zatytułowanego Zrozumienie ryzyka pojawienia się koronawirusa nietoperza. Pod jego patronatem Shi Zhengli jest współautorem artykułu z 2019 r., W którym wzywa się do dalszych badań nad syntetycznymi wirusami i testowania ich in vitro i in vivo:
Obecnie żadne leczenie kliniczne ani strategie profilaktyczne nie są dostępne dla żadnego ludzkiego koronawirusa. Biorąc pod uwagę zachowane RBD SARS-CoV i SARSr-CoV nietoperzy, niektóre opracowywane strategie anty-SARS-CoV, takie jak przeciwciała anty-RBD lub szczepionki oparte na RBD, powinny zostać przetestowane przeciwko SARSr-CoV nietoperzy. Ostatnie badania wykazały, że strategie anty-SARS-CoV działały tylko przeciwko WIV1, a nie SHC014. Ponadto niewiele informacji jest dostępnych na temat szczepów związanych z HKU3, które mają znacznie szerszy zasięg geograficzny i mają skrócone cechy w RBD. Podobnie, przeciwciała anty-S przeciwko MERS-CoV nie mogą chronić przed infekcją pseudowirusem niosącym nietoperza MERSr-CoV S. Ponadto niewiele wiadomo na temat replikacji i patogenezy tych wirusów nietoperzy. Dlatego przyszłe prace powinny koncentrować się na biologicznych właściwościach tych wirusów przy użyciu izolacji wirusa, genetyki odwrotnej oraz testów infekcji in vitro i in vivo. Uzyskane dane pomogłyby w przyszłości zapobiegać i kontrolować pojawiające się choroby podobne do SARS lub MERS.
Jeśli powyższy cytat może wydawać się niejasny, co dokładnie może oznaczać „korzystanie z odwrotnej genetyki”, sam NIH przyznaje to:
Cel 3. Charakterystyka in vitro i in vivo ryzyka rozprzestrzeniania się SARSr-CoV w połączeniu z analizami przestrzennymi i filogenetycznymi w celu zidentyfikowania regionów i wirusów stanowiących zagrożenie dla zdrowia publicznego. Wykorzystamy dane dotyczące sekwencji białka S, technologię klonowania zakaźnego, eksperymenty z infekcją in vitro i in vivo oraz analizę wiązania receptora w celu przetestowania hipotezy, że% progów dywergencji w sekwencjach białka S przewiduje potencjał rozlewania.
„Technologia klonowania zakaźnego” oznacza tworzenie żywych syntetycznych klonów wirusowych. Biorąc pod uwagę wysoki poziom przyjazności dla użytkownika i automatyzacji osiągnięty przez narzędzia inżynierii genetycznej, stworzenie syntetycznego CoV2 za pomocą powyższej metodologii byłoby w zasięgu nawet absolwenta.
Ale zanim zagłębimy się w pochodzenie CoV2, najpierw rzućmy okiem na jego biologię.
Biologia
Ok, zacznijmy od podstaw. Co to jest strona furinowa, RBM lub białko kolca? Bądź ze mną: kiedy przejdziesz przez dżunglę terminologii, koncepcyjnie wszystko jest całkiem proste. Na przykład białka szczytowe to te czerwone rzeczy wystające z cząsteczki wirusa - sam powód, dla którego wirusy te zostały „ukoronowane”:
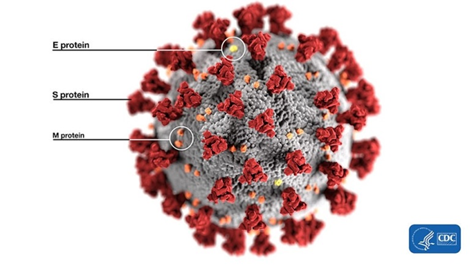
Za pomocą tych białek wirion przylega do receptora komórki ofiary (w naszym przypadku ACE2), aby następnie przeniknąć do środka. Jest to więc niezwykle ważna część wirusa, ponieważ bez dostania się do komórki wirusy nie mogą się replikować. Białko szczytowe określa również, które zwierzęta wirus może lub nie może zarazić, ponieważ receptory ACE2 (lub inne cele dla innych wirusów) u różnych gatunków mogą różnić się budową. Jednocześnie z całego 30-kilobazowego genomu (dość dużego jak na standardy wirusowe) gen tego białka stanowi zaledwie 12–13%. Zatem białko kolca ma tylko około 1300 aminokwasów. Poniżej przedstawiono strukturę białka kolca (S) w CoV2 i bliskich krewnych:

Jak widać na powyższym rysunku, białko S składa się z dwóch podjednostek: S1 i S2. To S1 wchodzi w interakcję z receptorem ACE2, a miejsce, w którym S1 to robi, nazywa się domeną wiązania receptora (RBD), podczas gdy obszar bezpośredniego kontaktu, święte z świętych, nazywa się motywem wiązania receptora (RBM). Oto piękna ilustracja z równie pięknego dzieła:
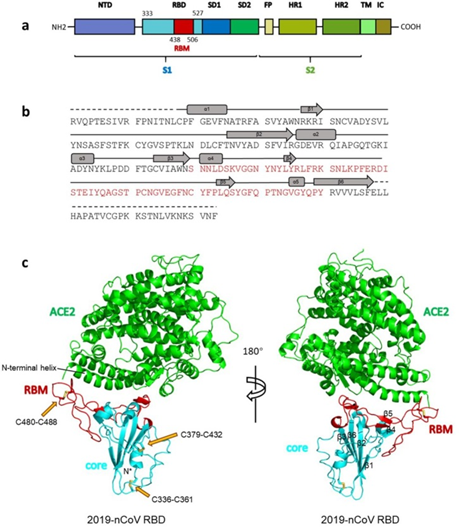
Ogólna struktura RBD 2019-nCoV związana z ACE2.
(a) Ogólna topologia monomeru szczytowego 2019-nCoV. NTD, domena N-terminalowa. RBD, domena wiążąca receptor. RBM, motyw wiążący receptor. SD1, subdomena 1. SD2, subdomena 2. FP, peptyd fuzyjny. HR1, powtórzenie heptad 1. HR2, powtórzenie heptad 2. TM, region transbłonowy. IC, domena wewnątrzkomórkowa.
(b) Sekwencje i struktury drugorzędne RBD 2019-nCoV. RBM ma kolor czerwony.
© Ogólna struktura RBD 2019-nCoV związana z ACE2. ACE2 ma kolor zielony. Rdzeń RBD 2019-nCoV jest w kolorze cyjanowym, a RBM w kolorze czerwonym. Wiązania dwusiarczkowe w RBD 2019-nCoV są pokazane jako sztyft i oznaczone żółtymi strzałkami. N-końcowa helisa ACE2 odpowiedzialna za wiązanie jest oznakowana.
Kiedy genom CoV2 został właśnie zsekwencjonowany i udostępniony publicznie 10 stycznia 2020 r., Była to zagadka, ponieważ nie były znane żadne ściśle powiązane szczepy. Ale dość szybko, 23 stycznia Shi Zhengli opublikowała artykuł wskazujący, że CoV2 jest w 96% identyczny z RaTG13, szczepem, który jej laboratorium wcześniej izolowało od nietoperzy z Yunnan w 2013 roku. Jednak poza jej laboratorium nikt nie wiedział o tym szczepie do stycznia 2020 r.
Od razu stało się jasne, że RaTG13 jest wyjątkowy. Spójrz na poniższy rysunek:
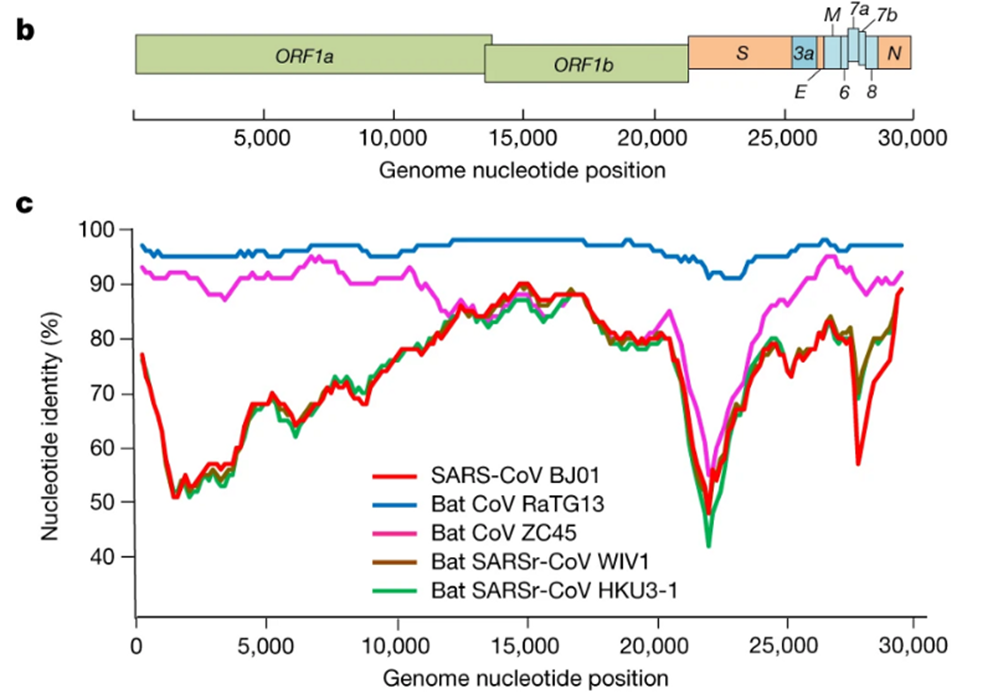
Jest to wykres podobieństwa genomu między CoV2 i innymi znanymi szczepami. Im wyższa krzywa, tym wyższy odsetek pasujących nukleotydów. Jak widać, w regionie genu białka szpiku (między nukleotydami 22k i 25k) tylko RaTG13 jest mniej więcej w pobliżu CoV2, podczas gdy wszystkie inne szczepy głęboko nurkują w tym miejscu - oba szczepy od innych nietoperzy i pierwszy SARS-CoV (czerwona krzywa). To samo w sobie nie jest podejrzane - kto wie, ile nieznanych szczepów podobnych do SARS czai się w jaskiniach nietoperzy w Yunnan? Ok, może nie jest do końca jasne, w jaki sposób wirus może się stąd dostać do Wuhan, ale hej, z tymi mokrymi rynkami, których nigdy nie znasz.
Łuskowce
Następnie na scenie pojawiły się pangoliny: w lutym inna grupa chińskich naukowców odkryła w swoim posiadaniu szczególny szczep koronawirusa łuskowca, który, choć ogólnie tylko w 90% podobny do CoV2, w regionie RBM był prawie identyczny z tym, że tylko jedna różnica aminokwasowa (patrz dwie górne sekwencje, kropki wskazują dopasowanie do górnej sekwencji):
Kontynuuj czytanie na:
https://medium.com/@yurideigin/lab-made-cov2-genealogy-through-the-lens-of-gain-of-function-research-f96dd7413748
zrodlo:https://miziaforum.com

Brak komentarzy:
Prześlij komentarz